Autor:
Louise Ward
Fecha De Creación:
11 Febrero 2021
Fecha De Actualización:
1 Mes De Julio 2024

Contenido
El tamaño de un átomo es tan pequeño que es difícil medir con precisión el número atómico de un compuesto químico. Para poder medir con precisión una cantidad de sustancias, los científicos usan una unidad de mol para representar un número específico de átomos. Un mol de sustancia se define como equivalente a la cantidad de átomos de carbono contenidos en 12 gramos del isótopo de 12 carbono, que es aproximadamente 6.022 x 10 átomos. Este valor se denomina número de Avogadro o constante de Avogadro. Esto también se conoce como el número de átomos en 1 mol de cualquier elemento, y 1 mol de la masa de una sustancia se llama masa molar de esa sustancia.
Pasos
Método 1 de 2: calcular la masa molar de un elemento
Definición de masa molar. La masa molar de una sustancia es la masa (en gramos) de un mol de esa sustancia. Para calcular la masa molar de un elemento, multiplique su masa atómica por el factor de conversión de gramo por mol (g / mol).
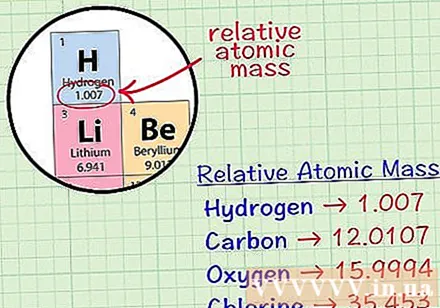
Encuentra el átomo cúbico promedio de un elemento. El átomo de masa promedio de un elemento es la masa promedio, en unidades atómicas, en una muestra que incluye todos los isótopos de ese elemento. Esta información generalmente se da en la tabla periódica de elementos. Al ubicar un elemento, puede encontrar un átomo cúbico promedio escrito justo debajo del símbolo químico del elemento. Este valor no es un número entero, sino un número con decimales.- Por ejemplo, con hidrógeno, el átomo de masa promedio es 1,007; El átomo cúbico medio de carbono es 12,0107; El átomo de masa promedio de oxígeno es 15.9994; el cloro tiene una masa atómica promedio de 35.453.

Multiplique el átomo de masa promedio por la constante de masa molar. La unidad de deslizamiento molar se define como 0,001 kilogramos por mol, o 1 gramo por mol. El producto del átomo de masa promedio y la constante de masa molar convierte la unidad de masa atómica en gramos por mol, por lo que la masa molar de hidrógeno será 1.007 gramos por mol, para el carbono es 12. , 0107 gramos por mol, de oxígeno es 15,9995 gramos por mol, y el de cloro es 35,453 gramos por mol.- Algunos elementos existen en la naturaleza como moléculas que constan de dos o más átomos iguales. Es decir, si desea calcular la masa molar de compuestos compuestos por más de un átomo, como gas hidrógeno, gas oxígeno o gas cloro, debe determinar la masa atómica promedio del compuesto y multiplicar este valor. con la masa molar constante, '' luego '' multiplique el producto que acaba de encontrar por 2.
- Con H2: 1.007 x 2 = 2.014 gramos por mol; para O2: 15.9994 x 2 = 31.9988 gramos por mol; y Cl2: 35,453 x 2 = 70,096 gramos por mol.
Método 2 de 2: Calcule la masa molar del compuesto.

Determine la fórmula estructural del compuesto. La fórmula estructural de una sustancia da el número atómico de cada elemento que forma ese compuesto. (Esta información está disponible en todos los libros de referencia). Por ejemplo, la fórmula química del ácido clorhídrico es HCl; de glucosa es C6H12O6. Con esta fórmula estructural, podemos determinar el número de cada tipo de átomo que constituye el compuesto en consideración.- Donde el HCl tiene un átomo de hidrógeno y un átomo de cloro.
- Molécula de azúcar glucosa C6H12O6 tiene 6 átomos de carbono, 12 átomos de hidrógeno y 6 átomos de oxígeno.
Determine el átomo de masa promedio de cada elemento constituyente. Usa la tabla periódica para encontrar el átomo de masa promedio de cada elemento presente en el compuesto. El átomo de masa promedio generalmente se escribe debajo del símbolo químico del elemento en la tabla periódica. Similar a calcular la masa molar de un elemento, multiplique el átomo de masa promedio por 1 gramo / mol.
- El átomo de masa promedio de los elementos que forman ácido clorhídrico es el siguiente: hidrógeno 1.007 g / mol y cloro 35.453 g / mol.
- El átomo de masa promedio de los elementos que componen la molécula de glucosa es: carbono, 12,017 g / mol; hidrógeno, 1.007 g / mol; y oxígeno, 15,9995 g / mol.
Calcule la masa molar de cada elemento componente. Al multiplicar el átomo de masa de un elemento por el número de átomos que aporta en un compuesto, se obtiene la masa promedio del elemento en el compuesto.
- En el caso del ácido clorhídrico, HCl, la masa molar del elemento hidrógeno es 1.007 g / mol, y la del cloro es 35.453 g / mol.
- En el caso de la glucosa, C6H12O6, la masa molar de cada elemento es la siguiente: carbono, 12,0107 x 6 = 72,0642 g / mol; hidrógeno, 1.007 x 12 = 12.084 g / mol; oxígeno, 15.9995 x 6 = 95.9964 g / mol.
Masa molar total de los elementos constituyentes. La masa molar total de los elementos de compostaje es la masa molar del compuesto.En el paso anterior calculamos la masa molar de cada elemento presente en el compuesto, en este paso solo necesitamos sumar todos estos valores.
- La masa molar del ácido clorhídrico es 1.007 + 35.453 = 36.460 g / mol. 36,46 gramos es la masa de 1 mol de ácido clorhídrico.
- La masa molar de glucosa es 72,0642 + 12,084 + 95,9964 = 180,1446 g / mol. Entonces, cada mol de glucosa tiene una masa de 180,14 gramos.
Consejo
- Aunque en la mayoría de los casos, el átomo de masa promedio se registra con una precisión de 1 parte 1000 (4 lugares decimales), en los laboratorios, la masa molar a menudo se reduce a 2 lugares decimales, a veces incluso menos, para moléculas grandes. Por lo tanto, en el caso de laboratorio, la masa molar del ácido clorhídrico se puede escribir como 36,46 gramos por mol, para glucosa 180,14 gramos por mol.
Que necesitas
- Libro de referencia química o tabla periódica de elementos.
- Computadora



