Autor:
Helen Garcia
Fecha De Creación:
21 Abril 2021
Fecha De Actualización:
1 Mes De Julio 2024
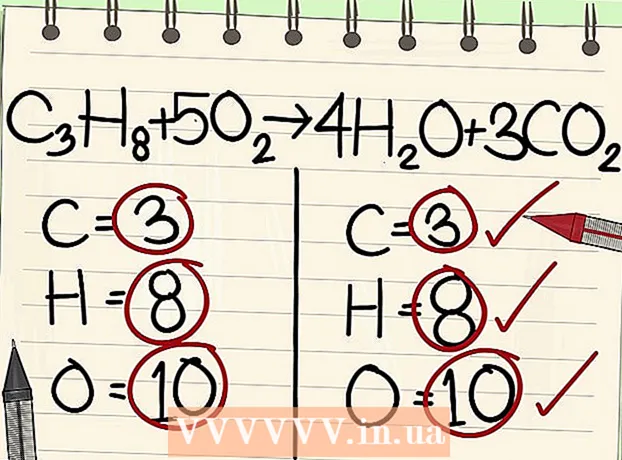
Contenido
Una ecuación química es una representación simbólica de una reacción química. En este caso, los compuestos que reaccionan (reactivos) se escriben a la izquierda y las sustancias resultantes (productos de reacción), en el lado derecho de la ecuación. Se coloca una flecha entre ellos de izquierda a derecha, que indica la dirección de la reacción. De acuerdo con la ley de conservación de la masa, en el curso de una reacción química, no pueden aparecer nuevos átomos o desaparecer los viejos; por lo tanto, el número de átomos en los reactivos debe ser igual al número de átomos en los productos de la reacción química. . Este artículo describe cómo equilibrar ecuaciones químicas utilizando diferentes métodos.
Pasos
Método 1 de 2: método tradicional
 1 Escribe una ecuación química. Como ejemplo, considere la siguiente reacción:
1 Escribe una ecuación química. Como ejemplo, considere la siguiente reacción: - C3H8 + O2 -> H2O + CO2
- Esta reacción describe la combustión de propano (C3H8) en presencia de oxígeno para formar agua y dióxido de carbono (dióxido de carbono).
 2 Escribe el número de átomos de cada elemento. Haz esto para ambos lados de la ecuación. Tenga en cuenta los subíndices junto a cada elemento para determinar el número total de átomos. Escriba el símbolo de cada elemento en la ecuación y anote el número correspondiente de átomos.
2 Escribe el número de átomos de cada elemento. Haz esto para ambos lados de la ecuación. Tenga en cuenta los subíndices junto a cada elemento para determinar el número total de átomos. Escriba el símbolo de cada elemento en la ecuación y anote el número correspondiente de átomos. - Por ejemplo, en el lado derecho de la ecuación en consideración, como resultado de la suma, obtenemos 3 átomos de oxígeno.
- En el lado izquierdo, tenemos 3 átomos de carbono (C3), 8 átomos de hidrógeno (H8) y 2 átomos de oxígeno (O2).
- En el lado derecho tenemos 1 átomo de carbono (C), 2 átomos de hidrógeno (H2) y 3 átomos de oxígeno (O + O2).
 3 Guarde el hidrógeno y el oxígeno para más adelante, ya que forman parte de varios compuestos en los lados izquierdo y derecho. El hidrógeno y el oxígeno son parte de varias moléculas, por lo que es mejor equilibrarlos al final.
3 Guarde el hidrógeno y el oxígeno para más adelante, ya que forman parte de varios compuestos en los lados izquierdo y derecho. El hidrógeno y el oxígeno son parte de varias moléculas, por lo que es mejor equilibrarlos al final. - Antes de equilibrar el hidrógeno y el oxígeno, tendrá que volver a contar los átomos, ya que pueden ser necesarios factores adicionales para equilibrar otros elementos.
 4 Comience con el elemento menos frecuente. Si necesita equilibrar varios elementos, elija uno que sea parte de una molécula de reactivo y una molécula de productos de reacción. Entonces, el carbono debe equilibrarse primero.
4 Comience con el elemento menos frecuente. Si necesita equilibrar varios elementos, elija uno que sea parte de una molécula de reactivo y una molécula de productos de reacción. Entonces, el carbono debe equilibrarse primero.  5 Para equilibrar, agregue un factor delante de un solo átomo de carbono. Ponga un factor delante del carbono individual en el lado derecho de la ecuación para equilibrarlo con 3 carbonos en el lado izquierdo.
5 Para equilibrar, agregue un factor delante de un solo átomo de carbono. Ponga un factor delante del carbono individual en el lado derecho de la ecuación para equilibrarlo con 3 carbonos en el lado izquierdo. - C3H8 + O2 -> H2O + 3CO2
- Un factor de 3 delante del carbono en el lado derecho de la ecuación indica que hay tres átomos de carbono, que corresponden a los tres átomos de carbono en la molécula de propano en el lado izquierdo.
- En una ecuación química, puede cambiar los coeficientes frente a átomos y moléculas, pero los subíndices deben permanecer sin cambios.
 6 Luego equilibre los átomos de hidrógeno. Después de igualar el número de átomos de carbono en los lados izquierdo y derecho, el hidrógeno y el oxígeno permanecieron desequilibrados. El lado izquierdo de la ecuación contiene 8 átomos de hidrógeno, el mismo número debe estar a la derecha. Consiga esto con una proporción.
6 Luego equilibre los átomos de hidrógeno. Después de igualar el número de átomos de carbono en los lados izquierdo y derecho, el hidrógeno y el oxígeno permanecieron desequilibrados. El lado izquierdo de la ecuación contiene 8 átomos de hidrógeno, el mismo número debe estar a la derecha. Consiga esto con una proporción. - C3H8 + O2 -> 4H2O + 3CO2
- Hemos agregado un factor de 4 a la derecha, ya que el subíndice muestra que ya tenemos dos átomos de hidrógeno.
- Si multiplica el factor 4 por el subíndice 2, obtiene 8.
- Como resultado, se obtienen 10 átomos de oxígeno en el lado derecho: 3x2 = 6 átomos en tres moléculas de 3CO2 y cuatro átomos más en cuatro moléculas de agua.
 7 Equilibra los átomos de oxígeno. Recuerde factorizar los coeficientes que utilizó para equilibrar los otros átomos. Debido a que agregó los coeficientes frente a las moléculas en el lado derecho de la ecuación, la cantidad de átomos de oxígeno cambió. Ahora tiene 4 átomos de oxígeno en moléculas de agua y 6 átomos de oxígeno en moléculas de dióxido de carbono. Por tanto, hay 10 átomos de oxígeno en el lado derecho.
7 Equilibra los átomos de oxígeno. Recuerde factorizar los coeficientes que utilizó para equilibrar los otros átomos. Debido a que agregó los coeficientes frente a las moléculas en el lado derecho de la ecuación, la cantidad de átomos de oxígeno cambió. Ahora tiene 4 átomos de oxígeno en moléculas de agua y 6 átomos de oxígeno en moléculas de dióxido de carbono. Por tanto, hay 10 átomos de oxígeno en el lado derecho. - Agregue un factor de 5 a la molécula de oxígeno en el lado izquierdo de la ecuación. Cada pieza contiene ahora 10 átomos de oxígeno.
- C3H8 + 5O2 -> 4H2O + 3CO2.

- Entonces, ambos lados de la ecuación contienen la misma cantidad de átomos de carbono, hidrógeno y oxígeno. La ecuación está equilibrada.
Método 2 de 2: Método algebraico
- 1 Escribe la ecuación de la reacción. Como ejemplo, considere la siguiente reacción química:
- PCl5 + H2O -> H3correos4 + HCl
- 2 Ponga una letra delante de cada conexión:
- aPCl5 + BH2O -> CH3correos4 + DHCl
- 3 Iguale el número de átomos de cada elemento en los lados izquierdo y derecho de la ecuación.
- aPCl5 + BH2O -> CH3correos4 + DHCl
- A la izquierda tenemos 2B átomos de hidrógeno (2 en cada H2O), mientras que a la derecha es 3C+D átomos de hidrógeno (3 en cada H3correos4 y 1 en cada molécula de HCl). Dado que los lados izquierdo y derecho deben contener el mismo número de átomos de hidrógeno, 2B debe ser igual a 3C+D.
- Haga esto para todos los elementos:
- PAG: a=C
- Cl: 5a=D
- H: 2B=3C+D
- 4 Resuelve el sistema de ecuaciones para encontrar los valores numéricos de los coeficientes. El sistema tiene varias soluciones, ya que hay más variables que ecuaciones. Es necesario encontrar una solución de este tipo para que todos los coeficientes tengan la forma de los números enteros más pequeños posibles.
- Para resolver rápidamente un sistema de ecuaciones, asigne un valor numérico a una de las variables. Suponga que a = 1. Resolvamos el sistema y encontremos los valores de las variables restantes:
- Para P a = c, entonces c = 1
- Para Cl 5a = d, por lo tanto d = 5
- Dado que para H 2b = 3c + d, encontramos el valor b:
- 2b = 3 (1) + 5
- 2b = 3 + 5
- 2b = 8
- b = 4
- Así, tenemos los siguientes coeficientes:
- a = 1
- b = 4
- c = 1
- d = 5
Consejos
- Si tiene dificultades, puede utilizar una calculadora en línea para equilibrar las ecuaciones químicas. Sin embargo, tenga en cuenta que no se permite utilizar dicha calculadora durante el examen, así que no confíe únicamente en ella.
- Recuerde, ¡a veces la ecuación se puede simplificar! Si todos los coeficientes son incluso divisibles por un número entero, simplifique la ecuación.
Advertencias
- Para deshacerse de los coeficientes fraccionarios, multiplique la ecuación completa (sus lados izquierdo y derecho) por el denominador de la fracción.
- Nunca use fracciones como coeficientes de la ecuación química; no hay medias moléculas o átomos en las reacciones químicas.
- En el proceso de equilibrio, puede usar fracciones por conveniencia, pero la ecuación no está equilibrada siempre que tenga coeficientes fraccionarios.