Autor:
John Pratt
Fecha De Creación:
17 Febrero 2021
Fecha De Actualización:
26 Junio 2024

Contenido
- Al paso
- Método 1 de 2: Cálculo de la masa molar de un elemento
- Método 2 de 2: Cálculo de la masa molar de una sustancia compuesta
- Consejos
- Advertencias
- Artículos de primera necesidad
Los átomos son demasiado pequeños para realizar mediciones significativas de sustancias químicas. Para poder trabajar con cantidades muy pequeñas de una sustancia en particular, estos son clasificados por los científicos en unidades de mol. Un mol se define como una cierta cantidad de sustancia con tantas partículas como el número de átomos de carbono en 12 gramos del isótopo C-12, lo que equivale aproximadamente a 6.022 14 × 10. Esto se llama número o constante de Avogadro. Se usa para indicar el número de átomos, moléculas, iones o partículas subatómicas en cualquier sustancia, y la masa de 1 mol es la masa molar de esa sustancia. Aquí puede leer cómo calcular la masa molar de elementos y sustancias.
Al paso
Método 1 de 2: Cálculo de la masa molar de un elemento
 Encuentre la masa atómica relativa del elemento. La masa atómica relativa de un elemento es el promedio ponderado, expresado en unidades de masa atómica (u), de las masas atómicas de todos los isótopos naturales. Esta información se puede encontrar en la tabla periódica. Por ejemplo, el hidrógeno tiene una masa atómica relativa de 1,008; carbono 12,0107; oxígeno 15,9994; y cloro 35,453.
Encuentre la masa atómica relativa del elemento. La masa atómica relativa de un elemento es el promedio ponderado, expresado en unidades de masa atómica (u), de las masas atómicas de todos los isótopos naturales. Esta información se puede encontrar en la tabla periódica. Por ejemplo, el hidrógeno tiene una masa atómica relativa de 1,008; carbono 12,0107; oxígeno 15,9994; y cloro 35,453. 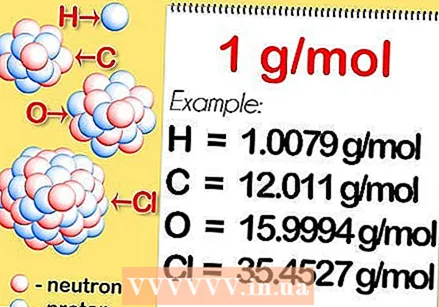 Multiplica por la masa molar. Esto se define como 1 gramo por mol. Esto convierte la unidad de masa atómica en gramos por mol, lo que hace que la masa molar de hidrógeno sea igual a 1.008 gramos por mol, carbono 12.0107 gramos por mol, oxígeno 15.9994 gramos por mol y cloro 35.453 gramos por mol.
Multiplica por la masa molar. Esto se define como 1 gramo por mol. Esto convierte la unidad de masa atómica en gramos por mol, lo que hace que la masa molar de hidrógeno sea igual a 1.008 gramos por mol, carbono 12.0107 gramos por mol, oxígeno 15.9994 gramos por mol y cloro 35.453 gramos por mol. - Encuentre la masa molar de una molécula divalente. Algunos elementos solo se pueden encontrar en moléculas de 2 o más. Esto significa que si desea calcular la masa molar de un elemento que, por ejemplo, está formado por 2 átomos, como hidrógeno, oxígeno y cloro, determine la masa atómica relativa y multiplíquela por la masa molar, y multiplique la resultado por 2.
- La masa molar de un elemento es entonces igual a la masa molar de un átomo multiplicada por el número de átomos de cada molécula: en el caso del hidrógeno, 1,008 veces 2, o 2,016 gramos por mol; oxígeno, 15,9994 veces 2, o 31,9988 gramos por mol; y con cloro, 35,453 veces 2, o 70,096 gramos por mol.
Método 2 de 2: Cálculo de la masa molar de una sustancia compuesta
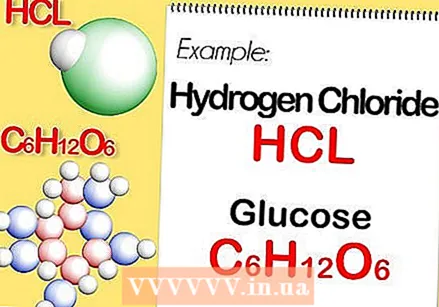 Determina la fórmula química del compuesto. Este es el número de átomos en cada elemento del compuesto. (Encontrará información sobre esto en, por ejemplo, Binas) Por ejemplo: la fórmula para el cloruro de hidrógeno (ácido clorhídrico) es HCl; para glucosa C6H.12O6. La última fórmula significa que la glucosa contiene 6 átomos de carbono, 12 átomos de hidrógeno y 6 átomos de oxígeno.
Determina la fórmula química del compuesto. Este es el número de átomos en cada elemento del compuesto. (Encontrará información sobre esto en, por ejemplo, Binas) Por ejemplo: la fórmula para el cloruro de hidrógeno (ácido clorhídrico) es HCl; para glucosa C6H.12O6. La última fórmula significa que la glucosa contiene 6 átomos de carbono, 12 átomos de hidrógeno y 6 átomos de oxígeno. 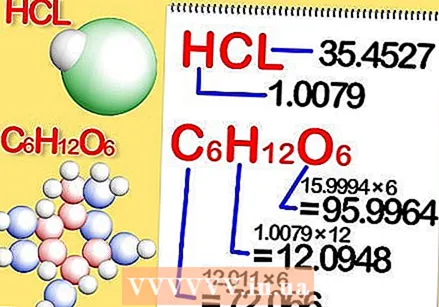 Determina la masa molar de cada elemento del compuesto. Multiplica la masa atómica del elemento por la masa molar y el número de átomos del elemento en el compuesto. Así es como funciona:
Determina la masa molar de cada elemento del compuesto. Multiplica la masa atómica del elemento por la masa molar y el número de átomos del elemento en el compuesto. Así es como funciona: - La masa molar de cada elemento de cloruro de hidrógeno, HCl, es 1.008 gramos por mol de hidrógeno y 35.453 gramos por mol de cloro.
- La masa molar de cada elemento de glucosa, C.6H.12O6, es 12.0107 veces 6, o 72.0642 gramos por mol de carbono; 1,008 veces 12, o 12,096 gramos por mol de hidrógeno; y 15.9994 veces 6, o 95.9964 gramos por mol de oxígeno.
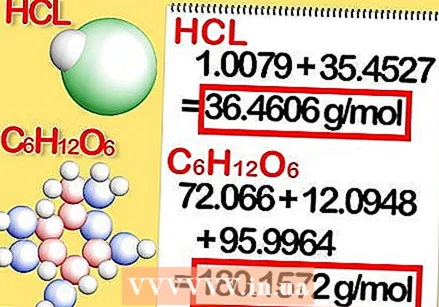 Agregue las masas molares de cada elemento del compuesto. Esto da la masa molar del compuesto. Así es cómo:
Agregue las masas molares de cada elemento del compuesto. Esto da la masa molar del compuesto. Así es cómo: - La masa molar del cloruro de hidrógeno es 1.008 + 35.453 o 36.461 gramos por mol.
- La masa molar de glucosa es 72.0642 + 12.096 + 95.9964, o 180.1566 gramos por mol.
Consejos
- Si bien en la mayoría de los casos las masas atómicas relativas tienen una precisión de 4 lugares decimales, en el laboratorio se aplica una precisión de 2 lugares decimales o menos para masas excepcionalmente grandes. Entonces, en el laboratorio, la masa molar del cloruro de hidrógeno es de 36,46 gramos por mol y la de la glucosa es de 180,16 gramos por mol.
Advertencias
- No confunda masa molar y masa molecular. Este último es la masa de una molécula individual de un elemento o compuesto. La masa molar puede entenderse como la masa promedio de todas las moléculas en una muestra de una sustancia en particular, al igual que la masa atómica relativa es el promedio de las masas atómicas de todos los isótopos.
Artículos de primera necesidad
- Binas y tabla periódica de los elementos.
- Calculadora