Autor:
Lewis Jackson
Fecha De Creación:
8 Mayo 2021
Fecha De Actualización:
25 Junio 2024
Contenido
La ecuación iónica neta es una parte importante de la química porque representa solo las partículas que cambian en una reacción química. Se utilizan más comúnmente en reacciones de oxidación-reducción, reacciones metabólicas y reacciones de neutralización de ácidos - bases. Hay tres pasos básicos para escribir una ecuación iónica neta: equilibrar la ecuación molecular, convertirla en la ecuación iónica completa (cómo existe cada sustancia en solución) y finalmente escribir la ecuación iónica neta.
Pasos
Parte 1 de 2: Comprender los componentes de la ecuación iónica
Conozca la diferencia entre moléculas y Compuestos iónicos. El primer paso para escribir una ecuación iónica neta es determinar los compuestos iónicos en la reacción. Los compuestos iónicos son aquellos que disocian iones en una solución acuosa y tienen carga eléctrica. Los compuestos moleculares son compuestos que nunca tienen carga eléctrica. Se forman entre dos no metales y, en ocasiones, se denominan compuestos covalentes.
- Los compuestos iónicos se pueden formar entre metales y no metales, metales e iones poliatómicos o múltiples iones poliatómicos.
- Si no está seguro de cuál es el compuesto, puede buscar los elementos de ese compuesto en la tabla periódica.

Reconoce la solubilidad de un compuesto. No todos los compuestos iónicos son solubles en solución acuosa, por lo que no pueden disociarse en iones. Debes identificar la solubilidad de cada compuesto antes de continuar con el resto de la ecuación. A continuación se muestra un resumen de las reglas de solubilidad. Encuentre una hoja de cálculo de solubilidad para obtener información más detallada y excepciones a estas reglas.- Siga estas reglas en el orden que se describe a continuación:
- Todas las sales de Na, K y NH4 todo se derrite.
- Todas las sales NO3, C2H3O2, ClO3y ClO4 todo se derrite.
- Todas las sales de Ag, Pb y Hg2 todo se derrite.
- Todas las sales de Cl, Br e I son solubles.
- Todas las sales de CO3, O, S, OH, PO4, CrO4, Cr2O7, y entonces3 se disuelven (excepto en algunos casos).
- Todas las sales SO4 se disuelven (excepto en algunos casos).
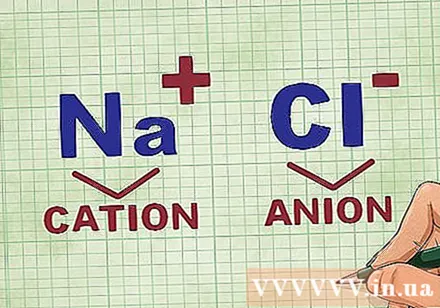
Determinación de cationes y aniones en un compuesto. Los cationes son los iones positivos en un compuesto y generalmente son el metal. El anión es el ion negativo del compuesto y no es metálico. Algunos no metales pueden formar cationes, pero los metales siempre forman cationes.- Por ejemplo, en NaCl, el Na es el catión cargado positivamente porque es un metal, y el Cl es el anión cargado negativamente porque no es un metal.

Reconoce los iones poliatómicos en la reacción. Los iones poliatómicos son moléculas cargadas que están estrechamente unidas y no se disocian durante las reacciones químicas. Es importante reconocer los iones poliatómicos porque tienen una carga específica y no se disocian. Los iones poliatómicos pueden tener carga positiva o negativa.- Si está estudiando química general, a menudo es necesario recordar algunos iones poliatómicos comunes.
- Algunos iones poliatómicos comunes son CO3, NO3, NO2, ENTONCES4, ENTONCES3, ClO4 y ClO3.
- También puede encontrar muchos otros iones en libros de química o en Internet.
Parte 2 de 2: escribir una ecuación iónica neta
Equilibrar ecuaciones moleculares. Antes de escribir una ecuación iónica neta, debe asegurarse de que su ecuación molecular esté equilibrada. Para equilibrar la ecuación, agregue coeficientes delante del compuesto para que el número atómico de cada elemento sea igual en ambos lados de la ecuación.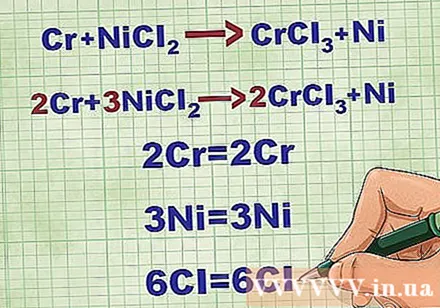
- Escribe el número de átomos que forman cada compuesto en ambos lados de la ecuación.
- Agregue un coeficiente frente a elementos que no sean oxígeno e hidrógeno para equilibrar cada lado.
- Equilibrio del átomo de hidrógeno.
- Equilibrio atómico de oxígeno.
- Cuente el número de átomos en cada lado de la ecuación para asegurarse de que estén equilibrados.
- Por ejemplo, Cr + NiCl2 -> CrCl3 + Ni Equilibrado a 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni.
Identifica el estado del compuesto en la ecuación. Muchas veces en el problema hay palabras clave que le permiten conocer el estado de cada compuesto. Existen varias reglas para ayudar a determinar el estado de un elemento o compuesto.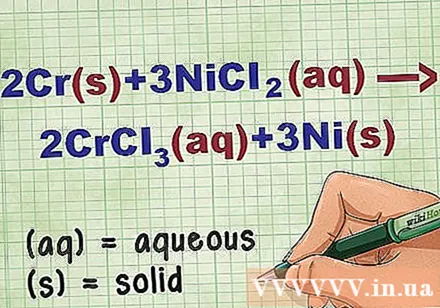
- Si no se proporciona el estado de un elemento, utilice el estado que se encuentra en la tabla periódica.
- Si el compuesto se llama solución, puede escribirlo como acuoso o (dd).
- Si hay agua en la ecuación, debe determinar si el compuesto iónico es soluble en agua usando la hoja de cálculo de solubilidad. Si la solubilidad es alta, el compuesto será acuoso (dd), si la solubilidad es baja, el compuesto será sólido (r).
- Sin agua, el compuesto iónico es sólido (r).
- Si el problema es ácido o básico, entonces el compuesto es acuoso (dd).
- Por ejemplo, 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni. Las formas elementales de Cr y Ni están en estado sólido. NiCl2 y CrCl3 Los compuestos iónicos son solubles, por lo que son acuosos. Reescriba la ecuación como: 2Cr(r) + 3NiCl2(dd) -> 2CrCl3(dd) + 3Ni(r).
Determine qué compuestos se disociarán (se disociarán en cationes y aniones) en solución. Cuando una sustancia o compuesto se disocia, se disocia en un ion cargado positivamente (catión) y un ion cargado negativamente (anión). Estos son los componentes que se equilibrarán al final de la ecuación iónica neta.
- Los sólidos, líquidos, gases, compuestos moleculares, compuestos iónicos de baja solubilidad, iones poliatómicos y ácidos débiles no se disociarán.
- Los compuestos iónicos tienen una alta solubilidad (use la tabla de solubilidad) y los ácidos fuertes ionizarán al 100% (HCl(dd), HBr(dd), HOLA(dd), H2ENTONCES4(dd), HClO4(dd)y HNO3(dd)).
- Tenga en cuenta que, aunque los iones poliatómicos ya no se disocian, si son constituyentes de ese compuesto, se disocian del compuesto.
Calcule la carga de cada ion disociado del compuesto. Recuerde que los metales formarán iones positivos y los no metales formarán iones negativos. Usa la tabla periódica para determinar la carga de un elemento. También debe equilibrar la carga de cada ion en el compuesto.
- En este ejemplo, NiCl2 disociado en Ni y Cl mientras que CrCl3 dividir en Cr y Cl.
- El Ni tiene una carga de 2+ porque el Cl tiene una carga negativa pero tiene 2 átomos. Por lo tanto, tenemos que equilibrar los 2 iones Cl negativos. El Cr tiene una carga de 3+, por lo que tenemos que equilibrar los 3 iones Cl negativos.
- Recuerda que los iones poliatómicos tienen una carga específica.
Escribe la ecuación iónica completa. Todo lo que se disocia o ioniza (ácidos fuertes) se separa en dos iones separados. El estado de la sustancia permanece (dd), pero asegúrese de que la ecuación aún esté equilibrada.
- Los sólidos, líquidos, gases, ácidos débiles y compuestos iónicos de baja solubilidad no cambian de estado ni se separan en iones. Los mantenemos intactos.
- Las sustancias moleculares se dispersarán en solución por lo que su estado cambia a (dd). Tres excepciones no son volverse (dd) es: CH4(k), C3H8(k), y C8H18(l).
- Continuando con el ejemplo anterior, la ecuación iónica completa se ve así: 2Cr(r) + 3Ni(dd) + 6Cl(dd) -> 2Cr(dd) + 6Cl(dd) + 3Ni(r). Cuando el Cl no está presente en un compuesto, no es una sustancia bifásica, por lo que multiplicamos el coeficiente por el número de átomos en el compuesto para obtener 6 iones Cl en ambos lados de la ecuación.
Elimina los iones de equilibrio cancelando los mismos iones en cada lado de la ecuación. Puede cancelar solo si son exactamente iguales en ambos lados (carga, número atómico, etc.). Vuelva a escribir la ecuación sin las sustancias destructibles.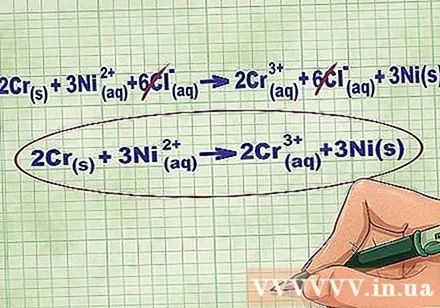
- Después de completar el ejemplo, tenemos 6 iones de equilibrio Cl cancelables en cada lado. La ecuación iónica neta es 2Cr(r) + 3Ni(dd) -> 2Cr(dd) + 3Ni(r).
- Si está en lo correcto, entonces la carga total en el lado del reactivo debe ser igual a la carga total en el lado del producto en la ecuación iónica neta.
Consejo
- Escribe los estados de todas las sustancias en la ecuación, si no será perder puntos.



