Autor:
Lewis Jackson
Fecha De Creación:
5 Mayo 2021
Fecha De Actualización:
1 Mes De Julio 2024

Contenido
Mol es la unidad de medida estándar en química, que se utiliza para observar los diferentes elementos de un compuesto. Por lo general, la masa del compuesto se calcula en gramos (g) y debe convertirse a unidades molares. La transición es bastante simple, sin embargo, todavía hay algunos pasos importantes que debemos seguir. Con el método siguiente, puede convertir fácilmente gramos a moles.
Pasos
Parte 1 de 2: Calcular la masa molecular
Prepara los útiles necesarios para resolver el problema matemático. Cuando tenga todas las herramientas disponibles, será más fácil resolver el problema. Lo que necesitas es:
- Lápiz y papel. Las matemáticas se vuelven más fáciles cuando escribes todo en un papel. Debes presentar todos los pasos para alcanzar la puntuación máxima.
- Tabla periódica de elementos químicos: se utiliza para determinar la masa de átomos de los elementos.
- Calculadora de bolsillo: se utiliza para calcular números complicados.

Determina qué elementos hay en el compuesto que necesitas convertir a unidades molares. El primer paso para calcular la masa molecular es determinar los elementos que componen el compuesto. Esto es fácil porque la abreviatura de elementos es solo de uno a dos caracteres.- Si una sustancia se abrevia con dos letras, la primera letra estará en mayúscula y la segunda letra en minúscula. Ejemplo: Mg es la abreviatura del elemento magnesio.
- Compuestos de NaHCO3 consta de cuatro elementos: sodio (Na), hidrógeno (H), carbono (C) y oxígeno (O).
Determina la cantidad de átomos de cada elemento del compuesto. Necesita saber el número atómico de cada sustancia en un compuesto para calcular la molécula de masa de ese compuesto. El pequeño número junto a las iniciales del elemento representa el número atómico del elemento.- Ejemplo: compuesto H2O tiene dos átomos de hidrógeno y un átomo de oxígeno.
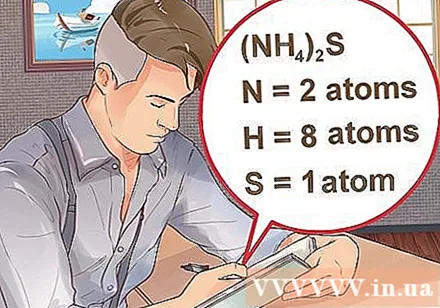
- Si un compuesto se escribe entre paréntesis, seguido de un índice pequeño, cada ingrediente entre paréntesis multiplica el índice. Ejemplo: compuesto (NH4)2S consta de dos átomos de N, ocho átomos de H y un átomo de S.

Escribe el papel atómico cúbico de cada elemento. Usar la tabla periódica es la forma más fácil de encontrar el átomo cúbico de un elemento. Después de ubicar el elemento en la tabla periódica, verá la masa atómica justo debajo del icono del elemento.- Por ejemplo, el átomo cúbico de oxígeno es 15,99.
Calcula la masa molecular. La molécula de masa de una sustancia es igual al número de átomos de cada elemento multiplicado por el átomo de masa de ese elemento. Esta cantidad es esencial en conversión de gramo a molar.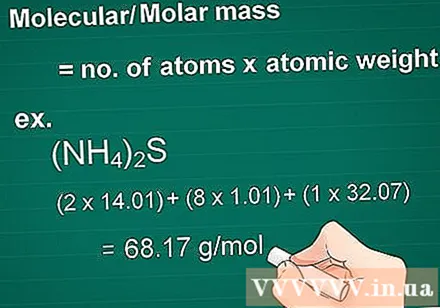
- Primero, multiplique el número atómico de cada elemento del compuesto por su átomo de masa.
- Luego, suma las masas de los elementos del compuesto.
- Ejemplo: masa molecular de un compuesto (NH4)2S = (2 x 14,01) + (8 x 1,01) + (1 x 32,07) = 68,17 g / mol.
- La masa molecular también se conoce como masa molar.
Parte 2 de 2: Convierte gramos a mol
Configure la fórmula de conversión. Para encontrar el número de moles del compuesto, divida el número de gramos del compuesto por la masa molar de ese compuesto.
- Fórmula: número de moles = masa (gramos) / masa molar del compuesto (gramos / mol)
Pon los números en la fórmula. Después de configurar la fórmula correcta, el siguiente paso es reemplazar los números que ha calculado en la fórmula. Si desea asegurarse de que los datos estén en la posición correcta, puede verificarlos suprimiendo la unidad. Si después de la simplicidad la unidad restante son moles, entonces está configurado correctamente.
Resuelve la ecuación. Usando una calculadora, divida la masa por la molécula cúbica de la sustancia o compuesto. El cociente será el número de moles de la sustancia o compuesto que está buscando.
- Por ejemplo, el problema es para 2 g de agua (H2O) y le pedirá que lo convierta a unidades molares. Tenemos la masa molar de H2O es 18 g / mol. Divida 2 entre 18, de modo que tenga 0,1111 mol de H2O.
Consejo
- No olvide incluir el nombre del elemento o compuesto con las respuestas.
- Si se le pide que presente un ejercicio o un cuestionario, asegúrese de mostrar sus respuestas claramente haciendo un círculo o dibujando un cuadro alrededor de las respuestas.
Que necesitas
- Tabla periódica química
- Lápiz
- Papel
- Computadora
- Problemas de quimica